- Оксигенотерапия
- Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
- Что такое ИВЛ?
- Показания к искусственной вентиляции легких
- Инвазивная вентиляция легких
- Кому и когда необходима инвазивная ИВЛ?
- Как работает аппарат инвазивной ИВЛ?
- Особенности оборудования для инвазивной вентиляции
- Неинвазивная вентиляция легких
- НИВЛ — что это?
- Когда применяется неинвазивная вентиляция легких?
- Оксигенотерапия (кислородотерапия)
- Аппарат боброва не работает
Оксигенотерапия
Что такое оксигенотерапия?
Оксигенотерапия — применение кислорода в лечебных целях.
Как проводится оксигенотерапия при помощи кислородной подушки?
Наиболее простым способом оксигенотерапии является ингаляционный способ через подушку. Для наполнения подушки кислородом снимают мундштук, открывают кран, подсоединяют трубку подушки к редуктору. Медленно открывают кран (вентиль) редуктора, наполняют подушку, закрывают краны редуктора и подушки, надевают мундштук. Перед употреблением мундштук протирают спиртом, обертывают влажной марлей для увлажнения кислорода, прикладывают ко рту больного и открывают кран на трубке подушки. Кислородные подушки бывают объемом 25-75 л. Средняя скорость подачи кислорода должна быть 4- 5 л в минуту. При этом способе оксигенотерапии происходит большая потеря кислорода, трудно установить его концентрацию и равномерность поступления в дыхательные пути.
Как проводится оксигенотерапия через носовые катетеры?
При этом способе потеря кислорода уменьшается. Для проведения оксигенотерапии на трубку вместо мундштука надевают тройник, а на два его свободных конца — два стерильных катетера, смазанных на носовом конце вазелиновым маслом. Можно проделать в носовом конце катетеров добавочные отверстия. Катетеры вводят через нижние носовые ходы в носоглотку и фиксируют завязками у крыльев носа. Кислород можно подавать из подушки, баллона или центрального распределителя и увлажнять через аппарат Боброва.
Какие еще существуют способы оксигенотерапии?
Существуют также способы подачи кислорода через маску и кислородную палатку. Последний способ наиболее эффективен и позволяет дозировать скорость подачи и концентрацию кислорода в палатке.
Источник
Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
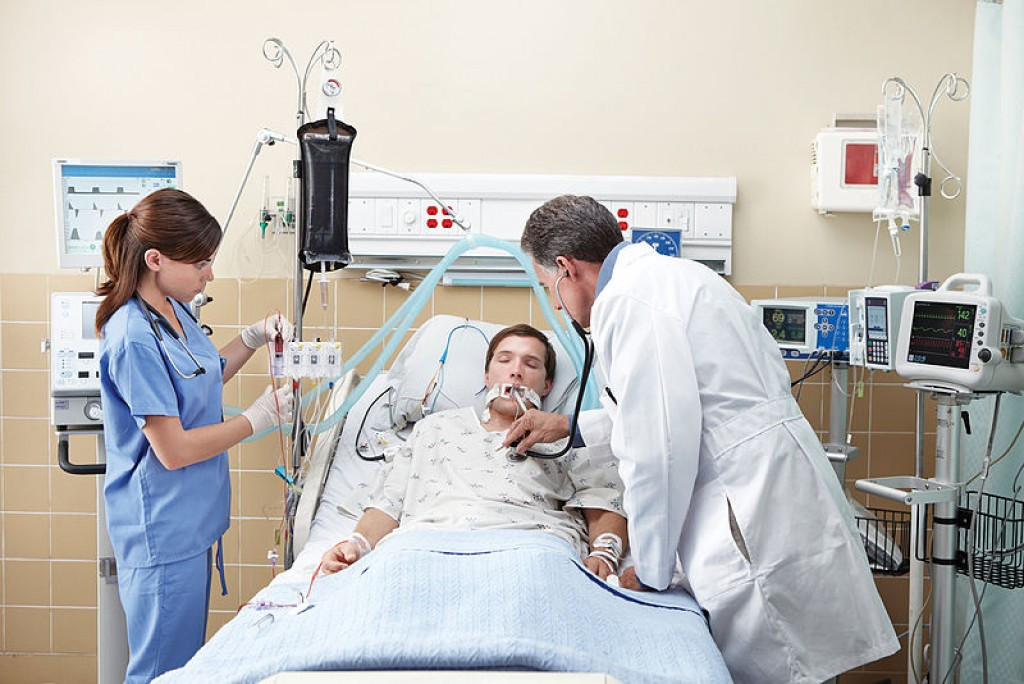
К искусственной вентиляции легких (ИВЛ) прибегают для оказания помощи пациентам с острой или хронической дыхательной недостаточностью, когда больной не может самостоятельно вдыхать необходимый для полноценного функционирования организма объем кислорода и выдыхать углекислый газ. Необходимость в ИВЛ возникает при отсутствии естественного дыхания или при его серьезных нарушениях, а также во время хирургических операций под общим наркозом.
Что такое ИВЛ?
Искусственная вентиляция в общем виде представляет собой вдувание газовой смеси в легкие пациента. Процедуру можно проводить вручную, обеспечивая пассивный вдох и выдох путем ритмичных сжиманий и разжиманий легких или с помощью реанимационного мешка типа Амбу. Более распространенной формой респираторной поддержки является аппаратная ИВЛ, при которой доставка кислорода в легкие осуществляется с помощью специального медицинского оборудования.
Показания к искусственной вентиляции легких
Искусственная вентиляция легких проводится при острой или хронической дыхательной недостаточности, вызванной следующими заболеваниями или состояниями:
- хроническая обструктивная болезнь легких (ХОБЛ);
- муковисцидоз;
- пневмония;
- кардиогенный отек легких;
- рестриктивные патологии легких;
- боковой амиотрофический синдром;
- синдром ожирения-гиповентиляции;
- кифосколиоз;
- травмы грудной клетки;
- дыхательная недостаточность в послеоперационный период;
- дыхательные расстройства во время сна и т. д.
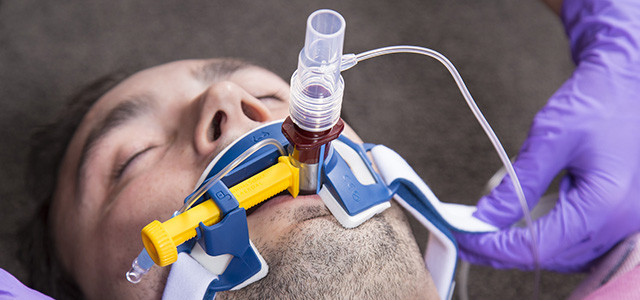
Инвазивная вентиляция легких
Эндотрахеальная трубка вводится в трахею через рот или через нос и подсоединяется к аппарату ИВЛ
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную прокачку легких кислородом и полностью берет на себя функцию дыхания. Газовая смесь подается через эндотрахеальную трубку, помещенную в трахею через рот или нос. В особо критических случаях проводится трахеостомия – хирургическая операция по рассечению передней стенки трахеи для введения трахеостомической трубки непосредственно в ее просвет.
Инвазивная вентиляция обладает высокой эффективностью, но применяется лишь случае невозможности помочь больному более щадящим способом, т.е. без инвазивного вмешательства.
Кому и когда необходима инвазивная ИВЛ?
Подключенный к аппарату ИВЛ человек не может ни говорить, ни принимать пищу. Интубация доставляет не только неудобства, но и болезненные ощущения. Ввиду этого пациента, как правило, вводят в медикаментозную кому. Процедура проводится только в условиях стационара под наблюдением специалистов.
Инвазивная вентиляция легких отличается высокой эффективностью, однако интубация предполагает введение пациента в медикаментозную кому. Кроме того, процедура сопряжена с рисками.
Традиционно инвазивную респираторную поддержку применяют в следующих случаях:
- отсутствие эффекта или непереносимость НИВЛ у пациента;
- повышенное слюнотечение или образование чрезмерного количества мокроты;
- экстренная госпитализация и необходимость немедленной интубации;
- состояние комы или нарушение сознания;
- вероятность остановки дыхания;
- наличие травмы и/или ожогов лица.
Как работает аппарат инвазивной ИВЛ?
Принцип работы приборов для инвазивной ИВЛ можно описать следующим образом.
- Для краткосрочной ИВЛ эндотрахеальная трубка вводится в трахею больного через рот или нос. Для долгосрочной ИВЛ на шее пациента делается разрез, рассекается передняя стенка трахеи и непосредственно в ее просвет помещается трахеостомическая трубка.
- Через трубку в легкие подается дыхательная смесь. Риск утечки воздуха сведен к минимуму, поэтому больной гарантированно получает нужное количество кислорода.
- Состояние больного можно контролировать с помощью мониторов, на которых отображаются параметры дыхания, объем подаваемой воздушной смеси, сатурация, сердечная деятельность и др. данные.
Особенности оборудования для инвазивной вентиляции
Оборудование для инвазивной вентиляции легких имеет ряд характерных особенностей.
- Полностью берет на себя функцию дыхания, т.е. фактически дышит вместо пациента.
- Нуждается в регулярной проверке исправности всех клапанов, т.к. от работоспособности системы зависит жизнь больного.
- Процедура должна контролироваться врачом. Отлучение пациента от аппарата ИВЛ также предполагает участие специалиста.
- Используется с дополнительными аксессуарами – увлажнителями, откашливателями, запасными контурами, отсосами и т. д.
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
- одышка в состоянии покоя;
- частота дыхания ЧД>25, участие в респираторном процессе вспомогательной дыхательной мускулатуры;
- гиперкапния (PaC02>45 и его стремительное нарастание);
- уровень Ph
Источник
Оксигенотерапия (кислородотерапия)
Оксигенотерапия (от лат. Oxygenium — «кислород» и др.-греч. θεραπεία) или кислородная терапия — метод лечения заболеваний с применением кислорода.
В воздухе объёмная доля кислорода — 21 %. Чистый кислород может оказать токсическое действие на организм, поэтому данный метод основан на вдыхании воздуха (газовой смеси) с повышенной концентрацией кислорода. Чистый кислород сильно высушивает дыхательные пути пациента, поэтому для его увлажнения используют аппарат Боброва — ёмкость с водой, через которую проходит газовая смесь.
Способы оксигенотерапии. Кислородная терапия может осуществляться как при естественном дыхании, так и при искусственной вентиляции лёгких. В домашних условиях используются, в первую очередь, домашние кислородные концентраторы, позволяющие осуществлять кислородную терапию до 24 часов в сутки на потоках до 5 литров в минуту. Кислородные подушки и кислородные баллоны — не эффективны, так как нуждаются в постоянных заправках кислородом, что в домашних условиях малоприменимо. Кислородные аэрозольные баллончики вообще не поддаются заправке, поэтому их использование оправдано только для создания кратковременного резерва кислорода. В больничных учреждениях подача кислорода централизована, то есть источник кислорода — хранилища со сжатым или жидким кислородом, откуда выполнена кислородная разводка по палатам. Чаще всего оксигенотерапию проводят путём ингаляции через носовые катетеры (канюли) реже используют носовые и ротовые маски, интубационные и трахеостомические трубки, кислородные тенты-палатки.
Домашний кислородный концентратор является наиболее эффективным решением для проведения длительной кислородной терапии. Стационарные домашние концентраторы кислорода уже более 10 лет применяются для проведения длительной кислородной терапии. Это самый удобный и недорогой способ получения кислорода. Кислородный концентратор для дома имеет небольшие размеры, весит 9-12 килограмм, перемещается по помещению на специальных роликах. Современный дизайн, простота использования и интуитивно понятное управление с современного дисплея делают его незаменимым в терапии пациентов с хронической дыхательной недостаточностью.
Современные кислородные концентраторы комплектуются мощным и долговечным компрессором, высококачественным цеолитом (это специальное вещество для заполнения воздухоразделительных колонок) и точной электроникой, отвечающей за работу всех систем прибора, точность концентрации и стабильность потока выходящего кислорода. При выборе кислородного концентратора для длительной кислородной терапии необходимо обращать внимание на уровень шума и вибрации, поскольку ДКТ проводится как днём, так и в ночное время, когда пациент спит.
Источник
Аппарат боброва не работает
При лечении любых неотложных состояний, связанных с гипоксией, первое, что требуется сделать еще до определения ее причины — обеспечить форсированную респираторную протекцию. Это один важных этапов терапии острых нарушений кардиореспираторных функций [18, 23].
Исторически первым вариантом респираторной протекции, существующим с эпохи ригидной бронхоскопии, явилась искусственная вентиляция лёгких (ИВЛ) — самый радикальный вариант воздействия на дыхательную систему, который обеспечивает полное замещение работы дыхательного центра и дыхательной мускулатуры [15, 16, 21].
Классическая вентиляция лёгких по Фриделю‒Лукомскому во время проведения бронхоскопии выполнялась по полуоткрытому контуру: вдох осуществлялся из кислородного баллона с помощью мешка наркозного аппарата, а выдыхаемый газ полностью выходил в атмосферу через клапан в дыхательном штуцере эндоскопа. При этом разгерметизация проксимального конца бронхоскопа при введении в него инструментов делала невозможным продолжение вентиляции лёгких, и все дополнительные эндобронхиальные манипуляции осуществлялись на фоне
апное [25, 62].
Сохранять постоянную вентиляцию лёгких позволила разработанная позднее инжекционная ИВЛ, позволяющая бронхологу проводить довольно длительные манипуляции в трахеобронхиальной системе в условиях негерметичного дыхательного контура у больных с выраженной обструкцией бронхов, при тяжёлых нарушениях газообмена, инородных телах дыхательных путей и других состояниях. При этом струя кислорода, подаваемая под давлением 1-4 кгс/см2 через инжекционную канюлю, создаёт вокруг конца последней разрежение, вследствие чего и происходит подсос атмосферного воздуха — инжекционный эффект Вентури [7, 16, 24, 26, 56].
И в настоящее время струйные способы ИВЛ являются главными методами респираторной поддержки при использовании жёсткого бронхоскопа (типа Фриделя) несмотря на то, что эффективность этого метода снижается при повышении сопротивления дыхательных путей и снижении растяжимости легких [16].
Ригидная бронхоскопия и могла быть осуществлена только благодаря ИВЛ. Однако и сейчас, в эпоху гибкой бронхоскопии, ИВЛ, замещая в тяжёлых ситуациях неэффективную работу дыхательного центра и дыхательной мускулатуры, при необходимости позволяет проводить и бронхологические вмешательства с помощью гибкого бронхоскопа. ИВЛ при этом осуществляется или через обычную интубационную трубку, или через ларингеальную маску. Её конструкция обеспечивает свободное поступление воздуха из дыхательного контура к больному, путём создания герметичного контакта с мягкими тканями гортаноглотки над входом в гортань больного [16, 32, 68].
Следующим этапом развития респираторного обеспечения ФБС явилось привлечение к этой проблеме возможностей высокочастотной ИВЛ, как варианта инвазивной.
Основным отличием респираторной механики высокочастотной струйной вентиляции легких от спонтанного дыхания и традиционных методов ИВЛ является, обусловленный высокой частотой дыхания (более 60 циклов/мин), феномен незавершенного выдоха. В связи с этим перед началом вдоха в альвеолах остается некоторый объём газовой смеси, что сопровождается появлением положительного давления, сохраняющегося и после оканчания выдоха. Причём, чем больше частота дыхания, тем больше выражен этот феномен. На уровень положительного давления оказывают влияние еще и ряд других факторов, таких как отношение продолжительности фаз дыхательного цикла, эластические свойства легких и грудной стенки (торако-пульмональный комплайнс), аэродинамическое сопротивление в дыхательных путях и некоторые другие. Физиологическое значение положительного давления состоит в том, что при умеренных его величинах происходит проникновение массы газа из хорошо вентилируемых альвеол в альвеолы, находящиеся в спавшемся состоянии. Тем самым происходит выравнивание вентиляционно-перфузионных соотношений в альвеоло-капиллярном секторе газообмена, уменьшение внутрилёгочного шунтирования крови и улучшение ее оксигенации [13, 16, 20, 21].
При высокочастотной вентиляции имеют место более низкие, чем при традиционных методах значения транспульмонального давления и давления в дыхательных путях, а также, как и при спонтанной вентиляции, сохраняется отрицательное давление в плевральных полостях. В отличие от традиционной ИВЛ, при высокочастотной вентиляции не отмечается депрессии гемодинамики и активации антидиуретического гормона, что рассматривается как следствие снижения стрессорных реакций. При высокочастотной вентиляции отмечается лучшее, чем при традиционных методах ИВЛ, внутрилёгочное распределение газов и меньшее шунтирование крови. При частотах, близких к 100 циклам в минуту, подавляется спонтанное дыхание при нормальных величинах напряжения углекислоты в артериальной крови и не требуется применения депрессоров дыхания для синхронизации больного с респиратором [11, 12].
Столь существенные достоинства высокочастотной ИВЛ не могли не способствовать её бурному развитию. На 70-90-е годы приходится основной пик публикаций об исследованиях различных аспектов высокочастотной вентиляции. В том числе она широко стала использоваться и при ригидной бронхоскопии [7, 12, 36, 63, 67].
Высокочастотную ИВЛ для респираторной протекции жёсткой бронхоскопии в настоящее время обычно проводят через специальный канал в тубусе аппаратом «Эол» под давлением 2-4 кгс/см2. При выполнении процедур, требующих синхронизации ритма ИВЛ с работой эндоскописта, целесообразно проведение струйной ИВЛ с ручным управлением путём периодического пережатия шланга, подводящего кислород, или с помощью механического прерывателя потока [16].
При проведении фибробронхоскопии (ФБС) в основном использовалась (и используется поныне) респираторная поддержка методом чрезкатетерной высокочастотной ИВЛ, при которой осуществляется подача прерывистой струи сжатого газа через тонкий катетер, проводимый в трахею через нижний носовой ход, чаще всего по методике Сельдингера (с помощью предворительного проведения проводника через бронхоскоп). Обычно используется в этом случае рабочее давление 1,2-2 атм., частота вентиляции 110-120 циклов в минуту и отношение вдох: выдох, равное 1:2. При наличии гиперкапнии рекомендуется увеличить рабочее давление до 2,5-3 кгс/см2. Этот вид протекции используется в ведении пациентов с миастенией, лёгочным кровотечением, стенозом трахеи, ателектазом лёгкого опухолевой этиологии, травмами грудной клетки. При этом далеко не всегда требуется прекращение самостоятельного дыхания — можно проводить респираторную поддержку и в режиме вспомогательной вентиляции лёгких. Прекращается высокочастотная струйная ИВЛ после прекращения ФБС путём постепенного снижения рабочего давления [9, 14, 16, 17, 19, 50].
Преимущества высокочастотной ИВЛ позволили, по мнению ряда авторов, использовать её для респираторной протекции ФБС у пациентов с тяжёлой соматической патологией (артериальная гипертензия, нестабильная стенокардия, аритмии), а также для предоперационной подготовки при планируемых вмешательствах на лёгких и средостении. При проведении данного варианта респираторной протекции авторы практически не наблюдали учащения пульса и повышения артериального давления [5, 16].
Но для осуществления этой методики, необходимо сначала установить катетер в трахеобронхиальном дереве, т.е. вызвать повышенный расход кислородных резервов у пациента с тяжёлой гипоксией, и лишь потом начать респираторную протекцию.
Заманчивым казалось обеспечить синхронность бронхологического вмешательства и оперативное восполнение кислородных резервов, осуществляя проведение струйной высокочастотной ИВЛ через биопсийный канал фибробронхоскопа. Однако ИВЛ приходится периодически прерывать в этой ситуации для выполнения манипуляций или аспирации бронхиального секрета. Кроме того, при частоте дыхательных циклов менее 100 в мин. у больных может появиться чувство распирания в грудной клетке на высоте вдоха, а при частоте более 150 в минуту может возникнуть гиперкапния в связи со снижением альвеолярной вентиляции, что требует увеличения рабочего давления. При проведении конца бронхоскопа в один из главных, а тем более долевых бронхов струя кислорода подается в ограниченный участок легкого, что может привести к его баротравме; при ошибочном введении катетера в пищевод кислород поступает в пищевод и желудок, резко раздувая последний, что может привести к его разрыву [16].
ИВЛ сама по себе связана с развитием таких тяжёлых осложнений, как нозокомиальные пневмонии, синуситы, сепсис, травмы гортани и трахеи, стенозы и кровотечения из верхних дыхательных путей. Эти осложнения вносят существенный вклад в неблагоприятный исход заболевания. Накопившиеся данные свидетельствуют, что ИВЛ может вызвать тяжёлые, порой необратимые изменения в легких, которые получили название «респиратор-ассоциированные повреждения легких» (ventilator-associated lung injury — VALI). Было установлено, что основной причиной этих осложнений являются: высокое содержание кислорода в кислородно-воздушной смеси (FIO2), высокое инспираторное давление, большие дыхательные объемы. Дополнительный отрицательный эффект у пульмонологических больных даёт седация, необходимая для обеспечения ИВЛ [10, 13, 47, 48, 66].
Таким образом, различные варианты проведения ИВЛ не могут претендовать на роль массового метода респираторной протекции ФБС.
Этих недостатков лишена группа методов, получившая название неинвазивной ИВЛ, т.е. предполагающая проведение вентиляционного пособия без постановки искусственных дыхательных путей — интубационных или трахеостомических трубок. Неивазивная ИВЛ позволяет безопасно и эффективно достичь разгрузки дыхательной мускулатуры, восстановления газообмена и уменьшения диспноэ у больных с острой дыхательной недостаточностью. Во время неинвазивной ИВЛ взаимосвязь пациент-респиратор осуществляется при помощи лицевых или носовых масок; пациент находится в сознании, может разговаривать, принимать пищу, откашливать мокроту. Как правило, не требуется применение седативных или миорелаксирующих препаратов [1, 2, 3, 4, 12, 22, 39, 46, 59, 60].
Были осуществлены попытки задействовать потенциальные возможности неинвазивной ИВЛ для респираторной протекции ФБС путём создания особых модификации масок или специальных шлемов для осуществления бронхологического пособия назальным доступом. Авторы отмечали хорошую переносимость процедуры, отсутствие в момент проведения ФБС эпизодов критической гипоксемии, нарушений сердечного ритма [40, 52, 65].
Однако сам факт проведения неинвазивной ИВЛ предъявляет повышенные требования к туалету трахеобронхиального дерева [1, 4, 46, 51, 59].
Многие авторы прямо указывают, что избыточная бронхиальная секреция, а также нарушения сознания (что как раз характерно для многих пациентов с выраженной бронхообструкцией и тяжёлой дыхательной недостаточностью) являются противопоказаниями к проведению неинвазивной ИВЛ [33, 22, 57, 59].
На сегодняшний день подобные разработки не могут быть доступны большинству лечебных учреждений в силу высокой стоимости оборудования и высокой технологичности респираторного пособия.
В последние годы проводятся экспериментальные исследования по применению частичной жидкостной вентиляции легких, основанной на заполнении функциональной остаточной ёмкости легких перфторуглеродами, так как в жидкости диффузия кислорода и углекислого газа происходит лучше, чем в воздухе. Частичная жидкостная вентиляция легких имеет два потенциальных преимущества:
1) раскрывает и стабилизирует альвеолы, лишенные сурфактанта;
2) уменьшает действия на альвеолы медиаторов системного воспалительного ответа и предотвращает прогрессирование легочного повреждения [16, 6, 8, 53].
В 2009 г. группой российских учёных (Попцов В.Н., Баландюк Л.Е.) было сообщено о первом успешном опыте проведения частичной жидкостной вентиляции лёгких на основе эндобронхиального введения перфторана для комплексного лечения респираторного дистресс-синдрома. Авторы отметили спустя 30 минут после болюсного введения 90 мл перфторана эндобронхиально повышение уровня оксигенации крови, но непосредственно после введения отмечено значительное повышение РаСО2. Кроме того, введение перфторана, требовало предшествующего проведения санационной ФБС. Следовательно, в настоящее время использовать частичную жидкостную вентиляцию лёгких на основе перфторуглеродных соединений для респираторного обеспечения собственно ФБС не представляется возможным [30].
Отдельным вариантом решения проблемы могут считаться попытки привлечения к респираторному обеспечению бронхологического пособия возможностей экстракорпоральной мембранной оксигенации, хорошо себя зарекомендовавшей в лечении острого респираторного дисстрес-синдрома [8, 37, 42, 55, 61].
В частности, было сообщено об успешно проведённой санационной ФБС у пациентки с массивной бронхообструкцией вязким бронхиальным секретом (вследствие альвеолярного протеиноза) на фоне экстракорпоральной мембранной оксигенации, когда значения сатурации кислорода (SaO2) не превышали 50 % [45].
Однако использование такой высокотехнологичной методики (контур для проведения экстракорпоральной оксигенации должен включать себя оксигенатор, теплообменники для подогрева перфузируемой крови, насосов роликового, центрифужного или перистальтического типов и т.д.) по определению не может быть массовым.
Существенно упростить методику респираторного обеспечения ФБС, сделать её доступной большинству эндоскопических отделений и кабинетов, а также отделений реанимации возможно, если она функционирует на основе респираторного обеспечения пациента, относящегося к самостоятельному дыханию кислородно-воздушной смесью.
На сегодняшний день описано несколько путей доставки кислорода в дыхательные пути пациента для поддержания естественной вентиляции лёгких кислородно-воздушной смесью.
Трахеальная газовая инсуффляция через катетер, трахеальную канюлю или эндотрахеальную трубку (свободный конец катетера расположен на несколько сантиметров выше бифуркации) позволяет уменьшить объём мёртвого пространства и обеспечить высокую фракцию кислорода. Кроме того, этот вид протекции можно комбинировать с различными режимами респираторной поддержки [1, 21, 11, 43, 44].
Описано использование метода для респираторной протекции ФБС. В частности, Ткачёва С.И., Каленбет Л.И., Рябов Е.В. с соавт. (2010) описали вариант временной окклюзии бронхо-плевральных свищей у больных с лёгочно-сердечной недостаточностью. ФБС проводилась при этом оральным доступом. Для коррекции гипоксии во время и после проведения ФБС кислород подавался или через интубационную трубку, предварительно введённую по тубусу фибробронхоскопа, или через маску небулайзера [31].
Однако инвазивный характер процедуры исключает её массовое использование для целей респираторной протекции бронхологического вмешательства. Доступность респираторной протекции ФБС возможна при условии, если она будет носить неинвазивный характер.
На сегодняшний день разработано несколько неинвазивных вариантов респираторной протекции на основе самостоятельного дыхания кислородно-воздушной смесью.
Самой простой и доступной системой доставки кислорода являются носовые канюли. Большим преимуществом этого метода является хорошая адаптация пациента. Они позволяют создать кислородно-воздушную смесь с содержанием кислорода (FiO2) до 24-40 % при потоке кислорода 1-5 л/мин (FiO2, % = 20 + 4∙поток кислорода, л/мин). Носовые канюли являются наиболее часто используемой системой при терапии хронической дыхательной недостаточности и также находят широкое применение в острых ситуациях. Однако при использовании носовых канюль невозможно точно установить инспираторную фракцию кислорода. Кроме того, происходит снижение FiO2 при увеличении минутной вентиляции лёгких, а также высушивание слизистой оболочки носа [1, 11, 44].
Простая лицевая маска позволяет создавать FiO2 от 35 до 60 % при потоке кислорода 5-15 л/мин. Для обеспечения «вымывания» углекислого газа рекомендуется поток кислорода свыше 5 л/мин. Маска предпочтительна для больных, которые дышат ртом из-за повышенной раздражительности слизистой носа. Простая лицевая маска также не позволяет точно установить инспираторную фракцию кислорода, а кроме того, как и при использовании носовых канюль, происходит снижение FiO2 при увеличении минутной вентиляции лёгких [1, 34, 44, 49].
Маска Вентури — тип маски, способный обеспечить довольно точное значение содержания кислорода в FiO2 (например, 24, 28, 31, 35 %), не зависящий от минутной вентиляции больного и инспираторного потока. Принцип работы основан на эффекте Вентури — кислород, проходя через узкое отверстие, создаёт область пониженного давления, что приводит к захвату воздуха. Маска Вентури достаточно безопасна в использовании в условиях гиперкапнической дыхательной недостаточности. Но при наличии тяжёлых пневмоний или при наличии интерстициального отёка лёгких (например, при ХОБЛ) могут понадобиться более высокие значения кислорода в кислородно-воздушной смеси, нежели может обеспечить маска Вентури. Это связано с появлением нового вида гипоксемии — внутрилёгочного шунтирования [1, 11, 44].
Однако при тяжёлой гипоксемии и потребности в FiO2 свыше 50 % и носовые канюли, и простая лицевая маска, и маска Вентури могут оказаться неэффективными методами доставки FiO2. В данной ситуации используют маски с расходным мешком (синонимы: нереверсивные маски, невозвратные масочные системы). Они позволяют при плотной подгонке маски к лицу достичь FiO2 до 90 %, хотя и сохраняют недостатки простых носовых масок в плане снижения FiO2 при увеличении минутной вентиляции лёгких [1, 34, 44].
Сравнительная характеристика неинвазивных методов подачи кислорода с использованием самостоятельного дыхания кислородно-воздушной смесью представлены в таблице. До настоящего времени были разработаны несколько способов респираторного обеспечения ФБС с использованием вариантов респираторной протекции пациента на основе самостоятельного дыхания кислородно-воздушной смесью.
Возможности различных средств доставки O2 (по Авдееву С.Н., 2006)
Источник