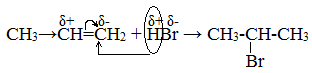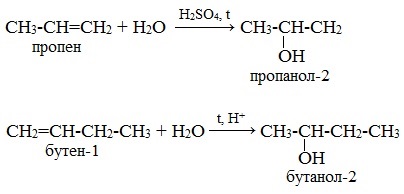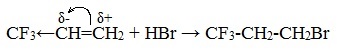- Правило Марковникова
- А : В →А• + •В
- А : В → А + + :В —
- Механизм электрофильного присоединения
- Присоединение против правила Марковникова
- Эффект Хараша: реакции, идущие против правила Марковникова
- Правило Марковникова
- Механизм реакции присоединения
- Что может повлиять на правило?
- Перекисный эффект Хараша
- Избирательность
- Когда правило марковникова не работает
Правило Марковникова
При протекании любой реакции, необходимо, чтобы разорвались старые связи между атомами и образовались новые. По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы:
А : В →А• + •В
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов:
А : В → А + + :В —
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион – так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Как определить по какому типу будет протекать разрыв?
1) Чем полярнее связь (чем больше разность ЭО атомов А и В), тем больше вероятность гетеролитического разрыва. Менее ЭО атом будет иметь +заряд – электрофильная частица, более электроотрицательный — отриц заряд – нуклеофильная частица.
2) Условия проведения реакции. Температура, свет способствует гомолитическому разрыву, образованию радикалов. А проведение реакций в полярном растворителе (вода) – способствует гетеролитическому разрыву. Наличие специальных катализаторов (кислот Льюиса), поляризующих химические связи, также обеспечивает гетеролитический разрыв.
Механизм электрофильного присоединения
Реакция гидрогалогенирования алкенов идет по механизму электрофильного присоединения с гетеролитическим разрывом связей.
Электрофильные («любящие электроны») реагенты, или короче, электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне (H + , CH3 + , Br + , Cl + , NO2 + , AlCl3 и т.п.)
Электрофилом в данном случае является протон Н + в составе молекулы галогеноводорода HX (X — галоген). К одному атому углерода присоединяется водород, к другому – хлор. В случае этилена нет разницы к какому атому присоединится водород, а к какому – хлор. А в случае пропена и других несимметричных УВ это имеет большое значение – т.к. получаются разные вещества.
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний.
Правило Марковникова можно объяснить другим способом – с точки зрения смещения электронной плотности в молекуле или электронных эффектов. Алкильные группы обладают так называемым положительным индуктивным электронным эффектом (+I-эффектом).
Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.
Например, в молекуле пропилена СН3–СН=СН2 метильная группа СН3 за счет суммирования небольшой полярности трех С–Н связей является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных p -электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе СН2) и появлению на нем частичного отрицательного заряда. На менее гидрогенизированном атоме углерода (в группе СН) возникает частичный положительный заряд.
Поэтому присоединение электрофильной частицы Н + происходит к более гидрогенизированному углеродному атому, а электроотрицательная группа Х присоединяется к менее гидрогенизированному атому углерода. По этому катион водорода H + присоединяется к первому атому углерода, Сl — — ко второму, т.е к противоположным зарядам.
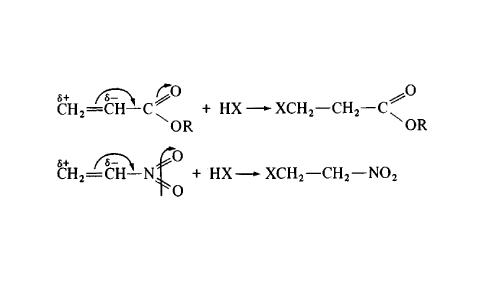
Присоединение против правила Марковникова
отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
Например, в реакции трихлорпропена Сl3C-CH=CH2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, что группа СCl3 проявляет отрицательный индуктивный эффект и электронная плотность пи-связи С=С смещена к менее гидрогенизированному атому углерода.
Сперва ответим на вопрос, почему алкены вступают в реакцию с электрофильными реагентами. Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако π-электронов над и под плоскостью молекулы).
Электрофильное присоединение протекает в несколько стадий.
I стадия: образование π-комплекса. π-Электронное облако двойной связи С=С взаимодействует с электрофилом (катион водорода).
II стадия (лимитирующая): образование карбокатиона.
Электрофил (Н+) присоединяется к одному из атомов углерода за счет электронной пары π-связи. На втором углеродном атоме, лишенном π-электронов, появляется положительный заряд.
III стадия: взаимодействие карбокатиона с анионом (например Cl-, образовавшемся при диссоциации HCl) которое приводит к продукту реакции.
Правило Марковникова по другому можно выразить так — присоединение электрофила происходит таким образом, чтобы образовался наиболее стабильный (устойчивый) каброкатион. Это и есть современная формулировка правила Марковникова: электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
Теперь давайте посмотрим, какие карбокатионы устойчивые и почему.
Устойчивость карбокатионов увеличивается в данном ряду слева направо.

Источник
Эффект Хараша: реакции, идущие против правила Марковникова
Возьмем самый простой несимметричный и ненасыщенный углеводород и самый простой симметричный и ненасыщенный. Ими окажутся соответственно пропен и бутен-2. Это алкены, и они любят вступать в реакции присоединения. Пусть, например, это будет присоединение бромоводорода. В случае с бутеном-2 возможен только один продукт — 2-бромбутан, к какому из атомов углерода бром ни присоединился бы — они все равноценны. А в случае с пропеном возможно два варианта: 1-бромпропан и 2-бромпропан. Однако экспериментально было доказано, что в продуктах реакции гидрогалогенирования 2-бромпропан заметно преобладает. То же самое верно для реакции гидратации: пропанол-2 будет основным продуктом.
Чтобы объяснить эту закономерность, Марковников сформулировал правило, которое и называется его именем.
Правило Марковникова
Распространяется на несимметричные алкены и алкины. При присоединении воды или галогеноводородов к таким молекулам их водород отправляется к наиболее гидрогенизированному атому углерода в двойной связи (то есть к такому, который содержит больше всего атомов углерода при себе). Это работает на последнем примере с пропеном: центральный атом углерода имеет при себе лишь один водород, а тот, что с краю, — целых два, поэтому бромоводород водородом цепляется за крайний атом углерода, а бромом — за центральный, и получается 2-бромпропан.
Конечно, правило соткано не из воздуха, и ему имеется нормальное объяснение. Однако для этого придется подробнее изучить механизм реакции.
Механизм реакции присоединения
Реакция проходит в несколько стадий. Начинается с того, что органическую молекулу атакует катион водорода (протон, в общем); атакует он один из атомов углерода при двойной связи, потому что электронная плотность там повышена. Положительно заряженный протон всегда ищет области с повышенной электронной плотностью, поэтому его (и другие частицы, ведущие себя так же) называют электрофилом, а механизм реакции, соответственно, — электрофильным присоединением.
Протон атакует молекулу, проникает в нее, и образуется положительно заряженный карбониевый ион. И тут как раз таки находится объяснение правилу Марковникова: карбкатион образуется самый устойчивый из всех возможных, а вторичный катион устойчивее первичного, третичный устойчивее вторичного и так далее (есть еще много способов стабилизировать карбкатион). А потом все легко — отрицательно заряженный галоген, или OH-группа присоединяются к положительному заряду, и образуется конечный продукт.
Если сначала вдруг образовался какой-то неудобный карбкатион, он может перегруппироваться так, чтобы было удобно и устойчиво (с этим связан такой интересный эффект, что иногда в ходе таких реакций присоединяемый галоген или гидроксильная группа оказываются вообще у другого атома углерода, не имевшего отношения к двойной связи, просто потому что положительный заряд в карбкатионе сместился в наиболее устойчивое положение).
Что может повлиять на правило?
Поскольку оно основано на распределении электронной плотности в карбкатионе, влиять могут разного рода заместители, находящиеся в органической молекуле. Например, карбоксильная группа: в ней есть кислород, зацепившийся с углеродом через двойную связь, и он оттягивает электронную плотность из двойной связи на себя. Поэтому в акриловой кислоте устойчивый карбкатион — на конце цепочки (подальше от карбоксильной группы), то есть такой, что в нормальных условиях был бы менее выгоден. Это один из примеров, когда реакция идет против правила Марковникова, однако общий механизм электрофильного присоединения сохраняется.
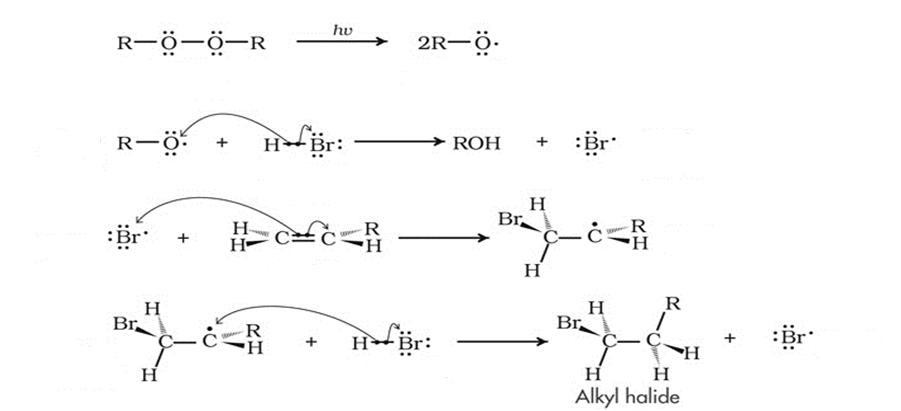
Перекисный эффект Хараша
В 1933 году Моррис Хараш проводил ту же реакцию гидробромирования несимметричных алкенов, однако в присутствии перекиси. И опять продукты реакции противоречили правилу Марковникова! Эффект Хараша, как его потом назвали, заключался в том, что в присутствии перекиси меняется весь механизм реакции. Теперь он не ионный, как раньше, а радикальный. Это обусловлено тем, что перекись сама сначала разваливается на радикалы, которые дают начало цепной реакции. Потом образуется радикал брома, потом — органической молекулы с бромом. Но радикал, как и карбкатион, более устойчивый — вторичный, поэтому сам бром оказывается на конце цепи.
Вот примерное описание эффекта Хараша в химических реакциях.
Избирательность
Стоит упомянуть, что данный эффект работает только при присоединении бромоводорода. С хлороводородом и йодоводородом ничего подобного не наблюдается. Для каждого из этих соединений на то свои причины.
В хлороводороде связь между водородом и хлором достаточно сильна. И если в радикальных реакциях, инициируемых температурой и светом, энергии достаточно, чтобы ее порвать, радикалы, образующиеся при распаде перекиси, на это практически неспособны, и реакция с хлороводородом по перекисному эффекту идет очень медленно.
В йодоводороде связь рвется гораздо легче. Однако сам радикал йода оказывается с крайне низкой реакционной способностью, и эффект Хараша опять совсем почти не работает.
Источник
Когда правило марковникова не работает
Правило Марковникова — при присоединении галогеноводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) углеродному атому (т.е. к атому С, связанному с большим числом атомов Н), а атом галогена (или группа –ОН) – к наименее гидрогенизированному.
Правило, устанавливающее направление реакции присоединения галогеноводородов (гидрогалогенирование) и воды (гидратация), сформулировал русский химик В.В. Марковников в 1869 г.
Правило Марковникова о присоединении по двойной связи объясняется смещением электронной плотности в молекулах несимметричных алкенов.
Механизм присоединения по правилу Марковникова
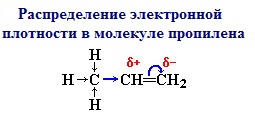
Электронная плотность в молекуле СН3-СН=СН2 до вступления в реакцию распределена неравномерно. Это обусловлено тем, что метильная группа СН3 за счет суммирования небольшой полярности трех С-Н-связей является донором электронов, т.е. проявляет +I-эффект ссылка по отношению к соседним атомам углерода.
Это вызывает смещение подвижности π-электронов двойной связи в сторону более гидрогенизированного атома углерода и появлению на нем частичного отрицательного заряда (δ-).
На другом, менее гидрогенизированном, атоме углерода возникает частичный положительный заряд (δ+). Поэтому атака электрофильной частицы Н+ происходит по более гидрогенизированному углеродному атому, а атом галогена или группа –ОН присоединяются к менее гидрогенизированному атому углерода.
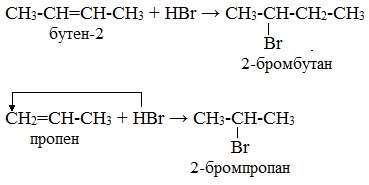
Например, гидробромирование бутена-2 и пропена:
Бутен-2 является симметричным алкеном, оба углеродных атома относительно двойной связи совершенно равноценны. В результате первой реакции образуется один продукт – 2-бромбутан.
Пропен – несимметричный алкен. Один углеродный атом при двойной связи более гидрогенизирован, т.е. содержит большее число атомов водорода. Поэтому продуктом реакции является 2-бромпропан.
Присоединение воды к несимметричным алкенам также происходит по правилу Марковникова.
Например, гидратация пропена и бутена-1:
В результате гидратации пропена образуется пропанол-2, а не пропанол-1. А в результате гидратации бутена-1 – бутанол-2, а не бутанол-1.
Если же в алкене присутствует электроноакцепторный заместитель, т.е. группа, обладающая способностью оттягивать на себя электронную плотность, более стабильным может оказаться первичный катион и реакция пойдет против правила Марковникова, например гидрогалогенирование трифторпропена.
Источник