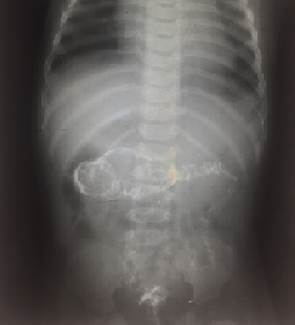
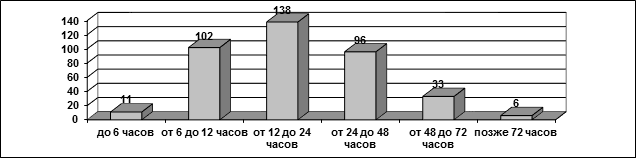Низкая кишечная непроходимость
Диагноз кишечной непроходимости можно заподозрить при антенатальном обследовании. При УЗИ плода обнаруживаются расширенные петли кишечника. При антенатальной диагностике кишечной непроходимости следует исключить муковисцидоз. С этой целью производят исследование крови как будущих родителей, так и плода на наличие гена муковисцидоза. Если оба родителя гетерозиготны по гену муковисцидоза, то весьма вероятно рождение больного 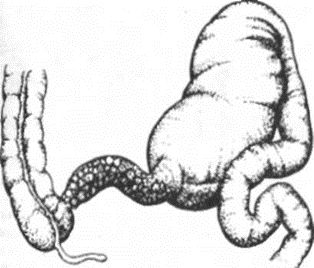
Если кишечная непроходимость была диагностирована антенатальной, сразу после рождения ребенка необходимо установить желудочный зонд и опорожнить желудок, и перевести новорожденного в специализированный стационар.
У ребенка с низкой кишечной непроходимостью с первых суток жизни появляется яркая клиника. Отмечается вздутие живота, отсутствует отхождение мекония, а вместо него из прямой кишки отходит светлая слизь, у ребенка отмечается рвота с примесью желчи, а затем застойным содержимым. При появлении данных симптомов необходимо незамедлительно исключить энтеральное кормление, установить желудочный зонд и опорожнить желудок, и перевести новорожденного в специализированный стационар.
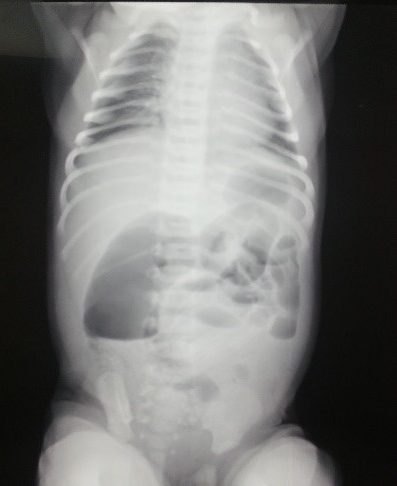
Для уточнения диагноза всем детям в первые часы необходимо производить ирригографию с водорастворимым контрастом. Ирригограмма при низкой кишечной непроходимости позволяет провести дифференциальную диагностику между атрезией тонкой кишки, мекониевым илеусом и болезнью Гиршпрунга.
При болезни Гиршпрунга на первом этапе возможно проведение консервативного лечения. При выявлении мекониевого илеуса проводятся высокие гипертонические клизмы с водорастворимым контрастом, что позволяет у большинства детей разрешить кишечную непроходимость.
Предоперационная подготовка при низкой кишечной непроходимость краткая, не более 3 часов. Определяются группа крови и резус фактор, биохимические показатели крови, кислотно-щелочное состояние, общий анализ крови, проводится инфузионная и антибактериальная терапия.
Объем оперативного пособия зависит от вида патологии и имеющихся осложнений. По возможности формируется первичный косой кишечный анастомоз по типу «конец в конец». Если из-за большой разницы в диаметре приводящего и отводящего отделов кишки сформировать первичный анастомоз не представляется возможным, то создается Т-образный разгрузочный анастомоз, или выводится энтеростома.
В послеоперационном периоде по мере восстановления пассажа по кишечнику начинается энтеральное кормление с постепенным увеличением объема. Выписка пациента из стационара возможна тогда, когда ребенок усваивает физиологический объем питания, и отмечается стойкая прибавка веса. Отдаленные результаты лечения удовлетворительные.
Источник
Не работает кишечник у новорожденного причины
В неонатальном периоде система пищеварения является особенно уязвимой, так как резкий переход от гемотрофного питания, имеющего место во внутриутробном периоде, к энтеральному после рождения, а также быстрое заселение желудочно-кишечного тракта (ЖКТ) бактериями, грибами и вирусами, при неустойчивом состоянии резистентности организма новорождённого, создаёт благоприятную почву для её повреждения. Анализ литературных данных показал, что, несмотря на актуальность проблемы, имеются лишь отдельные исследования, посвященные заболеваниям желудочно-кишечного тракта у новорожденных детей. Целый ряд работ отражает вопросы дисбиоза у доношенных новорожденных, но практически нет работ, посвященных острым кишечным инфекциям у новорожденных детей. При этом в структуре младенческой смертности среди инфекционных больных кишечные инфекции составляют от 50 до 70 % [1, 4].
Совершенствование системы выхаживания недоношенных детей повысило не только выживаемость таких детей, но и увеличило группу риска по развитию тяжелых заболеваний со стороны ЖКТ [3] и число детей с функциональными поражениями данной системы. Срыгивания и рвоты осложняют адаптацию от 20 до 67 % новорождённых и свидетельствуют об имеющихся гастроинтестинальных нарушениях, сформированных уже в неонатальном периоде [8].
Врожденные пороки развития не имеют тенденции к снижению в последние годы. Сохраняется высокая популяционная частота пороков у новорожденных от 2,5 до 4,5 %. В структуре врожденных пороков развития аномалии пищеварительного тракта занимают ведущее место, составляя 21,7 % — 25 % от всех пороков [6].
По определению Farrugia, M. K. (2003), некротизирующий энтероколит (НЭК) и перфорации желудочно-кишечного тракта у новорожденных относятся к заболеваниям, которые носят катастрофический характер. Среди доношенных новорожденных энтероколит формируется у детей на фоне снижения иммунитета, при этом происходит активация собственной условно-патогенной микрофлоры организма, что в свою очередь приводит к формированию локального инфекционного процесса, а при прогрессировании -генерализированной формы с развитием дополнительных очагов эндо- и экзогенной инфекции и суперинфекции различной локализации [2]. У недоношенных новорожденных некротизирующий энтероколит (НЭК) и перфорации желудочно-кишечного тракта являются наиболее тяжелым и угрожающим жизни заболеванием. Летальность при данной патологии составляет 40-80 % и достигает 100 % у пациентов с наиболее тяжелыми формами заболевания и сопутствующими патологическими состояниями [5]. В последние годы же отмечается отчетливая тенденция к увеличению числа случаев НЭК и перфораций желудочно-кишечного тракта у новорожденных [10]. В качестве ведущего механизма патогенеза НЭК рассматривается нарушение кровоснабжения кишечника, которое приводит к ишемии и воспалению. Недоношенные новорожденные с очень низкой и экстремально низкой массой тела при рождении, подвергшиеся хронической внутриутробной гипоксии, составляют группу пациентов с исходно высоким риском возникновения НЭК.
Таким образом, заболевания желудочно-кишечного тракта у новорожденных представляют собой гетерогенную группу, различны по структуре, течению, осложнениям и исходам в зависимости от сроков гестации, недостаточно изучены на сегодняшний день, что определяет актуальность исследования.
Цель исследования — изучение структуры заболеваний желудочно-кишечного тракта в зависимости от сроков гестации.
Материалы и методы исследования
В исследование были включены 403 новорожденных ребенка, 202 — доношенных и 201 недоношенный ребенок, из которых 138 детейс очень низкой массой тела (ОНМТ), и 63 — с экстремально низкой массой тела (ЭНМТ) при рождении. Средний гестационный возраст детей в группе с ОНМТ составил 31±0,5 недель, в группе детей с ЭНМТ 26,5±0,1 (р
Источник
Не работает кишечник у новорожденного причины
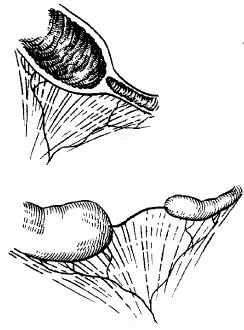
Инвагинация кишечника является самым частым видом приобретенной кишечной непроходимости у детей, при этом в абсолютном большинстве данная патология встречается у пациентов грудного возраста 3. Инвагинация кишечника относится к смешанной форме механической непроходимости (сочетание обтурации и странгуляции). К данной патологии приводит дискоординация кишечной перистальтики с образованием участков спазма, что способствует внедрению одного участка кишечника в другой, при этом чаще внедрение происходит по ходу перистальтики. У детей грудного возраста эта патология развивается на фоне анатомо-физиологических особенностей, к которым относятся подвижность подвздошной и слепой кишки, незрелость Баугиниевой заслонки [2; 3]. Именно с этими особенностями связано то, что инвагинация у детей до года чаще всего развивается в области илеоцекального угла. Кроме того, развитию данной патологии способствует возрастная физиологическая незрелость ферментативного аппарата кишечника. Значительная роль в возникновении инвагинации принадлежит нарушению режима вскармливания ребенка и факторам, способствующим изменению перистальтики кишечника – кишечным инфекциям [3].
К инвагинации кишечника приводят и различные органические причины: полипы кишечника, опухоли, удвоение различных отделов кишечника и т.п.
В диагностике кишечной инвагинации, кроме клинического исследования, большое значение отводится ультразвуковому исследованию, которое практически в 100% выявляет данную патологию [4].
Лечение инвагинации у большинства пациентов удается выполнить консервативными методами 4 Показания к операции: наличие перитонита, тонко-тонкокишечной инвагинации и безуспешность консервативного лечения [5].
Цель настоящего исследования – анализ результатов диагностики и лечения инвагинации кишечника у детей.
Материал и методы исследования
В основу работы включен анализ наблюдений за 386 детьми с инвагинацией кишечника в возрасте от 4 месяцев до 7 лет включительно, находящихся на лечении в хирургическом отделении педиатрического корпуса Самарской областной клинической больницы им. В Д. Середавина с 2011 по 2017 год. Мальчиков было 247, девочек – 139 (табл. 1). Наиболее часто инвагинация развивалась у детей до 1 года (224 человека, 58,0%).
Распределение наблюдаемых больных по полу и возрасту
Сроки госпитализации наших пациентов в хирургический стационар значительно колебались. В первые 6 часов от начала заболевания было госпитализировано лишь 11 (2,8%) человек, от 6 до 12 часов – 102 (26,4%) ребенка, от 12 до 24 часов – 138 (35,8%) детей, от 24 до 48 часов 96 (24,9%) детей, и позже 72 часов без хирургической помощи оставались 6 (1,6%) пациентов (рис. 1).
Рис. 1. Давность заболевания к моменту госпитализации в хирургический стационар
Всем больным проводилось клиническое обследование, применялись лабораторные, рентгенологические и ультразвуковые методы исследования.
При сборе анамнеза выявлено наличие погрешности в питании у 48 детей (12,4%). В 23 (6%) наблюдениях инвагинация развилась на фоне острой респираторной инфекции, у 29 (7,5%) пациентов – на фоне кишечной инфекции.
Клинические проявления кишечной инвагинации практически во всех наблюдениях были ярко выраженными.
Приступообразные боли в животе, которые выражались периодическим беспокойством, отмечались у 383 (99%) пациентов. Приступы болей длились от 5 до 15 минут. Промежутки времени между приступами были равны 10–20 минутам. У 322 (83%) больных наблюдалась повторяющаяся рвота, в начале заболевания – содержимым желудка, затем – с примесью желчи, у 11 пациентов отмечалась рвота застойным содержимым. В 86 наблюдениях (22%) отмечалось повышение температуры тела до субфебрильных значений. У 47 (12%) больных наблюдалось выделение крови из заднего прохода, причем у большинства – в виде «малинового желе».
При поступлении в детское хирургическое отделение состояние 45 детей (11,7%) было расценено как удовлетворительное, у 305 (79,0%) – средней тяжести. 39 (10,1%) пациентов поступили в стационар в тяжелом состоянии. Тяжелое состояние отмечено у детей, поступивших в стационар в сроки от начала заболевания более 48 часов.
Вздутие живота определялось у 115 детей (29,8%). Инвагинат пальпировался в виде опухолевидного подвижного, цилиндрической формы, умеренно болезненного образования в 223 наблюдениях (57,8%). Наличие симптома Данса отмечено в истории болезни 89 детей (23%). У 350 (90,6%) больных живот при пальпации был мягким, у 36 (9,4%) детей определялось напряжение мышц передней брюшной стенки.
В общем анализе крови у 331 ребенка количество лейкоцитов не превышало 10,0х109/л, у 21 пациента отмечался лейкоцитоз от 12,0 до 15,0х109/л, в 34 наблюдениях – от 16,0 до 25,0 х109/л (эти дети поступили в стационар позже 48 часов от начала заболевания, при этом 6 больных из них поступили позже 72 часов).
Всем наблюдаемым детям выполнено ультразвуковое исследование органов брюшной полости. 312 пациентам (81%) ультразвуковое исследование было дополнено рентгенологическим – ирригографией.
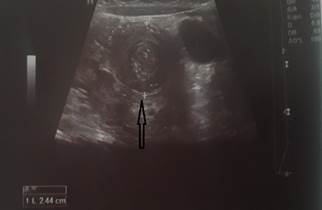
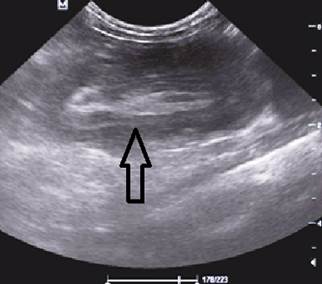
На рисунках 2 и 3 отображена ультразвуковая картина кишечной инвагинации.
Рис. 2. Симптом «мишени»
Рис. 3. Симптом «псевдопочки»
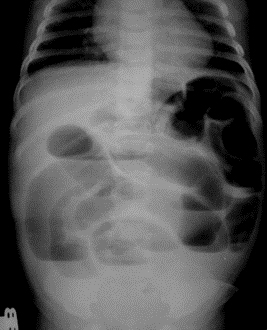
На рисунках 4 и 5 представлена картина кишечной инвагинации при рентгенологическом исследовании.
Рис. 4. Ирригограмма при тугом наполнении взвесью сульфата бария – симптом «клешней рака»
Рис. 5. Ирригограмма после опорожнения толстой кишки — симптом «кокарды»
ЛЕЧЕНИЕ. У 312 больных (80,8%) кишечная инвагинация устранена консервативно, у 2 больных (0,5%) инвагинация расправилась самопроизвольно. 72 ребенка (18,7%) оперированы. Показания к оперативному лечению были следующими:
— клинические признаки перитонита;
— тонко-тонкокишечная инвагинация (диагностирована при УЗИ);
— безуспешность консервативного лечения.
У 187 детей дезинвагинация произошла во время выполнения ирригографии.
В 125 наблюдениях инвагинация устранена при нагнетании в толстую кишку воздуха с контролем создаваемого давления. Этот метод используется нами у детей любого возраста. Для введения в прямую кишку воздуха мы применяем интубационную трубку (трубку для интубации трахеи), размер которой подбирается в зависимости от возраста ребенка. Трубка с помощью переходника соединяется с манометром и баллоном Ричардсона (рис. 6). Преимуществом данного устройства является наличие манжетки, которая позволяет создать герметизм при нагнетании воздуха в толстую кишку.
Рис. 6. Устройство для консервативного расправления инвагинации
Консервативная дезинвагинация проводится в операционной под общим обезболиванием. Перед манипуляцией необходимо произвести пальпацию живота для определения инвагината. Затем в прямую кишку пациента вводится интубационная трубка, после чего раздувается манжетка с целью создания герметизма во время нагнетания в кишку воздуха.
С помощью баллона Ричардсона начинается нагнетание воздуха, при этом отслеживается поступление воздуха в толстую кишку: в начале наблюдается асимметрия живота при прохождении воздуха до инвагината, при дальнейшем нагнетании воздуха при условии расправления инвагината живот становится симметричным в связи с прохождением воздуха в проксимальные отделы кишечника. В это время пальпаторно инвагинат перестает определяться. Затем от трубки отсоединяется баллон Ричардсона для удаления избыточного воздуха из кишечника. Ребенок помещается в палату. После полного пробуждения пациента выполняется обзорная рентгенография брюшной полости, на которой отмечается наличие газа как в толстой, так и в тонкой кишке.
В 26 наблюдениях консервативная дезинвагинация была безуспешной. Эти дети оперированы.
У 15 детей после пневмодезинвагинации и у 24 пациентов после дезинвагинации посредством ирригографии отмечен рецидив инвагинации. Эти дети оперированы.
Всего хирургическое лечение предпринято у 72 пациентов (табл. 2).
Источник